Progetti nazionali attivi.
PRIN 2022 - Are mitonuclear genomic interactions hidden drivers of adaptation and selection in animal species? - MIDAS (2023-2025)
 Le interazioni mitonucleari (MNI) sono considerate fattori evoluzionistici che mantengono l'integrità genomica delle specie, poiché molte funzioni cellulari dipendono dalla corretta interazione tra DNA mitocondriale (mtDNA) e nucleare (nDNA). Infatti, a causa del numero estremamente ridotto di geni del mtDNA, le funzioni mitocondriali dipendono fortemente da proteine codificate da >1.000 geni nucleari coadattati, come nel caso del sistema di fosforilazione ossidativa responsabile della produzione di ATP. Le funzioni mitocondriali sono centrali nel metabolismo energetico e nell’allocazione delle risorse, e l'entità degli effetti delle MNI sul fenotipo può variare notevolmente a seconda dell’ambiente. Pertanto, risulta fondamentale comprendere come le diverse combinazioni di varianti al mtDNA/nDNA si comportino in condizioni ambientali variabili per prevedere la risposta delle comunità animali a fattori di stress come quelli prospettati dagli scenari di cambiamento climatico. Per studiare adeguatamente le MNI, la disponibilità di genomi di riferimento annotati di alta qualità è un requisito chiave, insieme a popolazioni target altamente differenziate in termini di divergenza delle linee mitocondriali, specializzazione del metabolismo energetico e adattamento a climi contrastanti. Gli animali domestici rappresentano casi studio ideali per rispondere a questi interrogativi, poiché rispondono a tutti i prerequisiti di cui sopra. Per questa ragione MIDAS produrrà 180 sequenze genomiche complete e le analizzerà con gli strumenti bioinformatici più aggiornati (es., IA, Deep Learning) per studiare le MNI attraverso tre casi di studio relativi a specie, background genomici mitonucleari e interrogativi di ricerca differenti: 1) quanto la presenza di aplogruppi mitocondriali altamente divergenti influenzi le MNI (bovini); 2) quale sia il ruolo svolto dalle MNI nell'adattamento ad ambienti contrastanti (capre) e 3) se la specializzazione atletica possa essere guidata dalle MNI (cavalli). I dati e i risultati di MIDAS rappresenteranno un riferimento per future indagini sulle MNI a livello nazionale e potrebbero dimostrarsi strategici per migliorare la sostenibilità e la resilienza dei sistemi produttivi estensivi del nostro Paese riducendo al contempo l’impatto ambientale dell’allevamento.
Le interazioni mitonucleari (MNI) sono considerate fattori evoluzionistici che mantengono l'integrità genomica delle specie, poiché molte funzioni cellulari dipendono dalla corretta interazione tra DNA mitocondriale (mtDNA) e nucleare (nDNA). Infatti, a causa del numero estremamente ridotto di geni del mtDNA, le funzioni mitocondriali dipendono fortemente da proteine codificate da >1.000 geni nucleari coadattati, come nel caso del sistema di fosforilazione ossidativa responsabile della produzione di ATP. Le funzioni mitocondriali sono centrali nel metabolismo energetico e nell’allocazione delle risorse, e l'entità degli effetti delle MNI sul fenotipo può variare notevolmente a seconda dell’ambiente. Pertanto, risulta fondamentale comprendere come le diverse combinazioni di varianti al mtDNA/nDNA si comportino in condizioni ambientali variabili per prevedere la risposta delle comunità animali a fattori di stress come quelli prospettati dagli scenari di cambiamento climatico. Per studiare adeguatamente le MNI, la disponibilità di genomi di riferimento annotati di alta qualità è un requisito chiave, insieme a popolazioni target altamente differenziate in termini di divergenza delle linee mitocondriali, specializzazione del metabolismo energetico e adattamento a climi contrastanti. Gli animali domestici rappresentano casi studio ideali per rispondere a questi interrogativi, poiché rispondono a tutti i prerequisiti di cui sopra. Per questa ragione MIDAS produrrà 180 sequenze genomiche complete e le analizzerà con gli strumenti bioinformatici più aggiornati (es., IA, Deep Learning) per studiare le MNI attraverso tre casi di studio relativi a specie, background genomici mitonucleari e interrogativi di ricerca differenti: 1) quanto la presenza di aplogruppi mitocondriali altamente divergenti influenzi le MNI (bovini); 2) quale sia il ruolo svolto dalle MNI nell'adattamento ad ambienti contrastanti (capre) e 3) se la specializzazione atletica possa essere guidata dalle MNI (cavalli). I dati e i risultati di MIDAS rappresenteranno un riferimento per future indagini sulle MNI a livello nazionale e potrebbero dimostrarsi strategici per migliorare la sostenibilità e la resilienza dei sistemi produttivi estensivi del nostro Paese riducendo al contempo l’impatto ambientale dell’allevamento.
Capofila: Università degli Studi di Perugia
Partner: Università Cattolica del Sacro Cuore
Settori ERC: LS8_7 Evolutionary genetics, LS2_5 Genomics
Web / Social: https://www.instagram.com/prinmidas
PRIN 2022 - Updates on bovine besnoitiosis in Italy: novel insights into putative hosts and mechanical vectors of a neglected disease - BesnoBIT (2023-2025)
 La Besnoitiosi Bovina (BB) è una malattia parassitaria cronica e debilitante, che causa lesioni cutanee (ispessimento cutaneo, alopecia, ipercheratosi, scleroderma) e sistemiche (febbre, depressione, edema, perdita di peso, sterilità nei maschi e calo della produttività), compromettendo lo stato di salute e benessere dei bovini infetti. L’infezione può anche presentarsi in forma subclinica, e gli animali asintomatici contribuiscono a diffondere l’infezione tra la mandria. Endemica in Francia, Spagna e Portogallo, la BB è considerata malattia emergente in Europa, in espansione nella sua distribuzione geografica e nel numero di casi di infezione. Il maggior impatto economico della BB è perlopiù sul comparto del bovino da carne, nonostante alcuni focolai siano già stati riportati anche in aziende da latte. La malattia è causata dal protozoo Besnoitia besnoiti, il cui ciclo biologico è ancora in parte sconosciuto: il bovino rappresenta l’ospite intermedio, mentre si ipotizza che carnivori (quali volpe e gatto selvatico) siano ospiti definitivi. Resta da chiarire inoltre il ruolo di altre specie, quali altri ruminanti domestici e selvatici e gli equini; alcuni studi condotti su bufali e asini suggeriscono una certa suscettibilità all’infezione anche in queste specie. L’unica via di trasmissione dimostrata è quella attraverso il morso di insetti ematofagi quali Tabanidi e la mosca Stomoxys calcitrans, che rappresentano vettori meccanici del parassita. Inoltre, il contatto stretto tra animali (ad esempio durante la monta naturale) rappresenta una possibile via di infezione, e l’importazione di animali infetti da paesi endemici è causa di focolai di infezione in aree naïve. Attualmente, non esistono farmaci o vaccini efficaci nei confronti della malattia; l’unico controllo è quindi basato sull’applicazione di procedure diagnostiche standardizzate e di misure di biosicurezza. Seguendo le raccomandazioni dell’EFSA, che auspica l’implementazione delle misure di sorveglianza epidemiologica e sottolinea la necessità di aggiornare le conoscenze sulla BB, il progetto BesnoBIT (Aggiornamenti sulla Besnoitiosi bovina in Italia: nuovi approfondimenti su presunti ospiti e vettori meccanici di una malattia negletta) si prefigge di aggiornare l’epidemiologia dell’infezione da B. besnoiti in Italia, allo scopo di sviluppare Linee Guida per il controllo della BB applicabili al contesto zootecnico italiano. L’update epidemiologico sarà condotto su bovini da latte e da carne, asini e bufale allevati in tre aree di studio rappresentative del Nord Italia (Lombardia), dell’Italia Centrale (Umbria e Marche) e Meridionale (Campania e Basilicata), selezionate per le loro caratteristiche peculiari dal punto di vista zootecnico. Saranno inoltre raccolti dati sulla gestione aziendale. A corollario dell’indagine epidemiologica, una parte del progetto si occuperà inoltre di valutare, tramite indagini biomolecolari, il ruolo di carnivori selvatici (gatto selvatico e volpe) quali ospiti definitivi del parassita, nonché di svolgere studi entomologici mediante appositi trappolaggi di insetti vettori all’interno di aziende bovine afflitte dalla parassitosi. Il progetto BesnoBIT contribuirà in modo sostanziale a migliorare la conoscenza scientifica sulla BB, offrendo buone potenzialità di controllo e prevenzione circa l’introduzione e/o l’ulteriore diffusione della parassitosi in Italia. Inoltre, considerando che la BB acuta potrebbe essere confusa con altre malattie che colpiscono i bovini, i nuovi dati epidemiologici e i protocolli applicativi definiti nelle Linee Guida supporteranno i veterinari nella diagnosi accurata e precoce, necessaria per ridurre al minimo la diffusione della parassitosi e l’uso/abuso improprio di antibiotici o farmaci antinfiammatori non steroidei. In questa prospettiva, il progetto si allinea alle più recenti indicazioni della Commissione Europea e del Piano Nazionale di Ripresa e Resilienza (PNRR) “Italia Domani” relative alla sostenibilità dei processi produttivi, alla lotta contro la resistenza antimicrobica e al miglioramento del benessere degli animali.
La Besnoitiosi Bovina (BB) è una malattia parassitaria cronica e debilitante, che causa lesioni cutanee (ispessimento cutaneo, alopecia, ipercheratosi, scleroderma) e sistemiche (febbre, depressione, edema, perdita di peso, sterilità nei maschi e calo della produttività), compromettendo lo stato di salute e benessere dei bovini infetti. L’infezione può anche presentarsi in forma subclinica, e gli animali asintomatici contribuiscono a diffondere l’infezione tra la mandria. Endemica in Francia, Spagna e Portogallo, la BB è considerata malattia emergente in Europa, in espansione nella sua distribuzione geografica e nel numero di casi di infezione. Il maggior impatto economico della BB è perlopiù sul comparto del bovino da carne, nonostante alcuni focolai siano già stati riportati anche in aziende da latte. La malattia è causata dal protozoo Besnoitia besnoiti, il cui ciclo biologico è ancora in parte sconosciuto: il bovino rappresenta l’ospite intermedio, mentre si ipotizza che carnivori (quali volpe e gatto selvatico) siano ospiti definitivi. Resta da chiarire inoltre il ruolo di altre specie, quali altri ruminanti domestici e selvatici e gli equini; alcuni studi condotti su bufali e asini suggeriscono una certa suscettibilità all’infezione anche in queste specie. L’unica via di trasmissione dimostrata è quella attraverso il morso di insetti ematofagi quali Tabanidi e la mosca Stomoxys calcitrans, che rappresentano vettori meccanici del parassita. Inoltre, il contatto stretto tra animali (ad esempio durante la monta naturale) rappresenta una possibile via di infezione, e l’importazione di animali infetti da paesi endemici è causa di focolai di infezione in aree naïve. Attualmente, non esistono farmaci o vaccini efficaci nei confronti della malattia; l’unico controllo è quindi basato sull’applicazione di procedure diagnostiche standardizzate e di misure di biosicurezza. Seguendo le raccomandazioni dell’EFSA, che auspica l’implementazione delle misure di sorveglianza epidemiologica e sottolinea la necessità di aggiornare le conoscenze sulla BB, il progetto BesnoBIT (Aggiornamenti sulla Besnoitiosi bovina in Italia: nuovi approfondimenti su presunti ospiti e vettori meccanici di una malattia negletta) si prefigge di aggiornare l’epidemiologia dell’infezione da B. besnoiti in Italia, allo scopo di sviluppare Linee Guida per il controllo della BB applicabili al contesto zootecnico italiano. L’update epidemiologico sarà condotto su bovini da latte e da carne, asini e bufale allevati in tre aree di studio rappresentative del Nord Italia (Lombardia), dell’Italia Centrale (Umbria e Marche) e Meridionale (Campania e Basilicata), selezionate per le loro caratteristiche peculiari dal punto di vista zootecnico. Saranno inoltre raccolti dati sulla gestione aziendale. A corollario dell’indagine epidemiologica, una parte del progetto si occuperà inoltre di valutare, tramite indagini biomolecolari, il ruolo di carnivori selvatici (gatto selvatico e volpe) quali ospiti definitivi del parassita, nonché di svolgere studi entomologici mediante appositi trappolaggi di insetti vettori all’interno di aziende bovine afflitte dalla parassitosi. Il progetto BesnoBIT contribuirà in modo sostanziale a migliorare la conoscenza scientifica sulla BB, offrendo buone potenzialità di controllo e prevenzione circa l’introduzione e/o l’ulteriore diffusione della parassitosi in Italia. Inoltre, considerando che la BB acuta potrebbe essere confusa con altre malattie che colpiscono i bovini, i nuovi dati epidemiologici e i protocolli applicativi definiti nelle Linee Guida supporteranno i veterinari nella diagnosi accurata e precoce, necessaria per ridurre al minimo la diffusione della parassitosi e l’uso/abuso improprio di antibiotici o farmaci antinfiammatori non steroidei. In questa prospettiva, il progetto si allinea alle più recenti indicazioni della Commissione Europea e del Piano Nazionale di Ripresa e Resilienza (PNRR) “Italia Domani” relative alla sostenibilità dei processi produttivi, alla lotta contro la resistenza antimicrobica e al miglioramento del benessere degli animali.
Capofila: Università degli Studi di Milano
Partner: Università degli Studi di Perugia
Settori ERC:LS6_5 Biology of pathogens (e.g. bacteria, viruses, parasites, fungi), LS9_10 Veterinary and applied animal sciences
Web / Social: https://www.instagram.com/besno.bit https://www.facebook.com/profile.php?id=61555939989128
PRIN PNRR 2022 - Valorising milk as natural resource for therapeutic purpose: bovine milk Extracellular Vesicles (mEVs) as anti-inflammatory and immunomodulatory agents - MilkEVIA (2023-2025)
 Il latte non solo rappresenta la principale fonte alimentare del neonato, ma fornisce anche componenti bioattivi essenziali per lo sviluppo del sistema immunitario. Un ruolo fondamentale in questo è attribuito alle vescicole extracellulari (EV), particolarmente abbondanti nel latte (mEV). Le EV sono micro-nano strutture racchiuse in un doppio strato fosfolipidico, che agiscono come vettori di messaggi tra cellule attraverso il trasporto di molecole di vario tipo come metaboliti, lipidi, RNA e micro RNA (miRNA). A seguito dell’ingestione di latte, l’endocitosi delle EV da parte di cellule riceventi può regolare l’immunità innata e adattativa anche attraverso cambiamenti epigenetici. Le EV, infatti, conferiscono protezione al cargo molecolare, resistendo ad ambienti sfavorevoli come quello gastrico, ed hanno la capacità di oltrepassare le barriere biologiche. Le mEV sono state recentemente studiate come terapia alternativa per le malattie infiammatorie croniche intestinali umane (IBD), la cui eziologia rimane per lo più sconosciuta, rendendo i vari approcci terapeutici applicati poco efficaci. Studi preliminari su mEV da latte vaccino in modelli di IBD hanno dimostrato proprietà antinfiammatorie e immunomodulanti, alleviando i sintomi della colite. Tali proprietà possono essere sfruttate anche in medicina veterinaria contro malattie caratterizzate da uno stato infiammatorio come le mastiti nelle vacche da latte e le enteriti nei suini. Queste patologie, infatti, rappresentano una delle principali cause di perdita economica a livello mondiale e contribuiscono allo sviluppo della resistenza antimicrobica a causa dell'uso massiccio di antibiotici in terapia. Pertanto, MilkEVIA ha lo scopo di utilizzare il latte in chiave terapeutica, sfruttando le mEV come agenti naturali per ridurre l’infiammazione e combattere malattie come IBD, mastite bovina ed enterite suina.In primo luogo, le mEV saranno stabilizzate in una formulazione per renderne applicabile l'uso in campo ( cliniche ed aziende agricole ) un punto cruciale non affrontato fino ad ora nel campo dei mEV. MilkEVIA potrà essere utile per il trattamento adiuvante di queste patologie ad alto impatto sociale ed ecomomico, e conseguentemente avere risvolti positivi in prospettiva “one Health”, potenzialmente riducendo l’uso di antibiotici e i loro residui nelle produzioni animali e nell’ambiente. Inoltre, l’uso nutraceutico delle mEV stabilizzate aumenterebbe notevolmente il valore economico di questa materia prima.
Il latte non solo rappresenta la principale fonte alimentare del neonato, ma fornisce anche componenti bioattivi essenziali per lo sviluppo del sistema immunitario. Un ruolo fondamentale in questo è attribuito alle vescicole extracellulari (EV), particolarmente abbondanti nel latte (mEV). Le EV sono micro-nano strutture racchiuse in un doppio strato fosfolipidico, che agiscono come vettori di messaggi tra cellule attraverso il trasporto di molecole di vario tipo come metaboliti, lipidi, RNA e micro RNA (miRNA). A seguito dell’ingestione di latte, l’endocitosi delle EV da parte di cellule riceventi può regolare l’immunità innata e adattativa anche attraverso cambiamenti epigenetici. Le EV, infatti, conferiscono protezione al cargo molecolare, resistendo ad ambienti sfavorevoli come quello gastrico, ed hanno la capacità di oltrepassare le barriere biologiche. Le mEV sono state recentemente studiate come terapia alternativa per le malattie infiammatorie croniche intestinali umane (IBD), la cui eziologia rimane per lo più sconosciuta, rendendo i vari approcci terapeutici applicati poco efficaci. Studi preliminari su mEV da latte vaccino in modelli di IBD hanno dimostrato proprietà antinfiammatorie e immunomodulanti, alleviando i sintomi della colite. Tali proprietà possono essere sfruttate anche in medicina veterinaria contro malattie caratterizzate da uno stato infiammatorio come le mastiti nelle vacche da latte e le enteriti nei suini. Queste patologie, infatti, rappresentano una delle principali cause di perdita economica a livello mondiale e contribuiscono allo sviluppo della resistenza antimicrobica a causa dell'uso massiccio di antibiotici in terapia. Pertanto, MilkEVIA ha lo scopo di utilizzare il latte in chiave terapeutica, sfruttando le mEV come agenti naturali per ridurre l’infiammazione e combattere malattie come IBD, mastite bovina ed enterite suina.In primo luogo, le mEV saranno stabilizzate in una formulazione per renderne applicabile l'uso in campo ( cliniche ed aziende agricole ) un punto cruciale non affrontato fino ad ora nel campo dei mEV. MilkEVIA potrà essere utile per il trattamento adiuvante di queste patologie ad alto impatto sociale ed ecomomico, e conseguentemente avere risvolti positivi in prospettiva “one Health”, potenzialmente riducendo l’uso di antibiotici e i loro residui nelle produzioni animali e nell’ambiente. Inoltre, l’uso nutraceutico delle mEV stabilizzate aumenterebbe notevolmente il valore economico di questa materia prima.
Capofila: Università degli Studi della Tuscia
Partner: Università degli Studi di Perugia e Università degli Studi di Roma "Tor Vergata"
Settori ERC:LS9_10 Veterinary and applied animal sciences, LS6_11 Innovative immunological tools and approaches, including therapies
Web / Social: SITOWEB
PRIN 2022 - Equine resilience and welfare in Climate change and stressful scenarios using Omic technologies and innovative low cost Sensors - ECOS (2023-2025)
 Per ottimizzare le loro interazioni con l’ambiente, gli animali, compreso l’uomo, sono incoraggiati a reagire a qualsiasi stimolo stressante attivando l’asse neuroendocrino-immunitario. La plasticità del genoma stabilizzerà questa risposta se l'esposizione allo stimolo sarà prolungata, adattando e mantenendo le "impronte" di questa nuova omeostasi. Alcuni tipi di stress sono globali e prolungati, come i cambiamenti climatici, e sugli animali influiscono sulle prestazioni, sulla salute, sulla produttività, sulla riproduzione e sulla suscettibilità alle malattie. Inoltre, lo stress da calore (HS) è più difficile da contrastare quando è combinato con un altro stress, come uno sforzo fisico intenso. ECOS indagherà la resilienza e il benessere in condizioni di HS e stress da esercizio utilizzando i cavalli come modello ideale per i mammiferi, compreso l'uomo. ECOS analizzerà i diversi meccanismi biologici di adattamento: caratteristiche genomiche (alleli/aplotipi), epigenomiche (metilazione e miRNA differenziali), trascrittomiche e metabolomiche. Verrano impiegati soggetti da razze autoctone del Sud Italia (Sanfratellano e Purosangue Orientale Siciliano) per indagare lo stress da calore/adattamento, e cavalli atleti in Italia e Qatar per lo studio dello stress/adattamento indotto dall’esercizio fisico in condizioni di HS. Per aprire la strada al pieno sfruttamento delle analisi omiche per la caratterizzazione genetica, epigenetica e metabolomica, verranno analizzati parametri ematologici chiave e verrà applicata la “fenotipizzazione profonda” (DEPH) utilizzando innovativi sensori custom di nuova generazione a basso costo (implementati dal gruppo di ricerca) per rilevare in tempo reale parametri fisiologici cruciali. Verranno quindi applicati algoritmi di intelligenza artificiale (AI) e l'approccio della biologia dei sistemi per identificare le caratteristiche omiche (ad esempio alleli/aplotipi genomici, firme epigenetiche) e i pathway genetici/metabolici associati ad una maggiore resilienza per aumentare il benessere animale. I risultati attesi includono: l'acquisizione di nuove conoscenze di base sulle caratteristiche molecolari di risposta all'HS e allo stress da esercizio, la messa a punto di sensori innovativi a basso costo per il rilevamento in tempo reale di parametri cruciali di stress, l'identificazione di biomarcatori diagnostici precoci di stress, l'identificazione delle caratteristiche genomiche di resilienza e benessere, per sviluppare strategie di mitigazione utilizzando modelli di intelligenza artificiale.
Per ottimizzare le loro interazioni con l’ambiente, gli animali, compreso l’uomo, sono incoraggiati a reagire a qualsiasi stimolo stressante attivando l’asse neuroendocrino-immunitario. La plasticità del genoma stabilizzerà questa risposta se l'esposizione allo stimolo sarà prolungata, adattando e mantenendo le "impronte" di questa nuova omeostasi. Alcuni tipi di stress sono globali e prolungati, come i cambiamenti climatici, e sugli animali influiscono sulle prestazioni, sulla salute, sulla produttività, sulla riproduzione e sulla suscettibilità alle malattie. Inoltre, lo stress da calore (HS) è più difficile da contrastare quando è combinato con un altro stress, come uno sforzo fisico intenso. ECOS indagherà la resilienza e il benessere in condizioni di HS e stress da esercizio utilizzando i cavalli come modello ideale per i mammiferi, compreso l'uomo. ECOS analizzerà i diversi meccanismi biologici di adattamento: caratteristiche genomiche (alleli/aplotipi), epigenomiche (metilazione e miRNA differenziali), trascrittomiche e metabolomiche. Verrano impiegati soggetti da razze autoctone del Sud Italia (Sanfratellano e Purosangue Orientale Siciliano) per indagare lo stress da calore/adattamento, e cavalli atleti in Italia e Qatar per lo studio dello stress/adattamento indotto dall’esercizio fisico in condizioni di HS. Per aprire la strada al pieno sfruttamento delle analisi omiche per la caratterizzazione genetica, epigenetica e metabolomica, verranno analizzati parametri ematologici chiave e verrà applicata la “fenotipizzazione profonda” (DEPH) utilizzando innovativi sensori custom di nuova generazione a basso costo (implementati dal gruppo di ricerca) per rilevare in tempo reale parametri fisiologici cruciali. Verranno quindi applicati algoritmi di intelligenza artificiale (AI) e l'approccio della biologia dei sistemi per identificare le caratteristiche omiche (ad esempio alleli/aplotipi genomici, firme epigenetiche) e i pathway genetici/metabolici associati ad una maggiore resilienza per aumentare il benessere animale. I risultati attesi includono: l'acquisizione di nuove conoscenze di base sulle caratteristiche molecolari di risposta all'HS e allo stress da esercizio, la messa a punto di sensori innovativi a basso costo per il rilevamento in tempo reale di parametri cruciali di stress, l'identificazione di biomarcatori diagnostici precoci di stress, l'identificazione delle caratteristiche genomiche di resilienza e benessere, per sviluppare strategie di mitigazione utilizzando modelli di intelligenza artificiale.
Capofila: Università degli Studi della Tuscia
Partner: Università degli Studi di Perugia e Università degli Studi di Catania
Settori ERC:LS9_10 Veterinary and applied animal sciences
Web / Social:
PRIN 2022 - GOJI BERRY FOR RABBITS: FEED, FOOD AND ANIMAL WELFARE BENEFITS - GORABBIT (2023-2025)
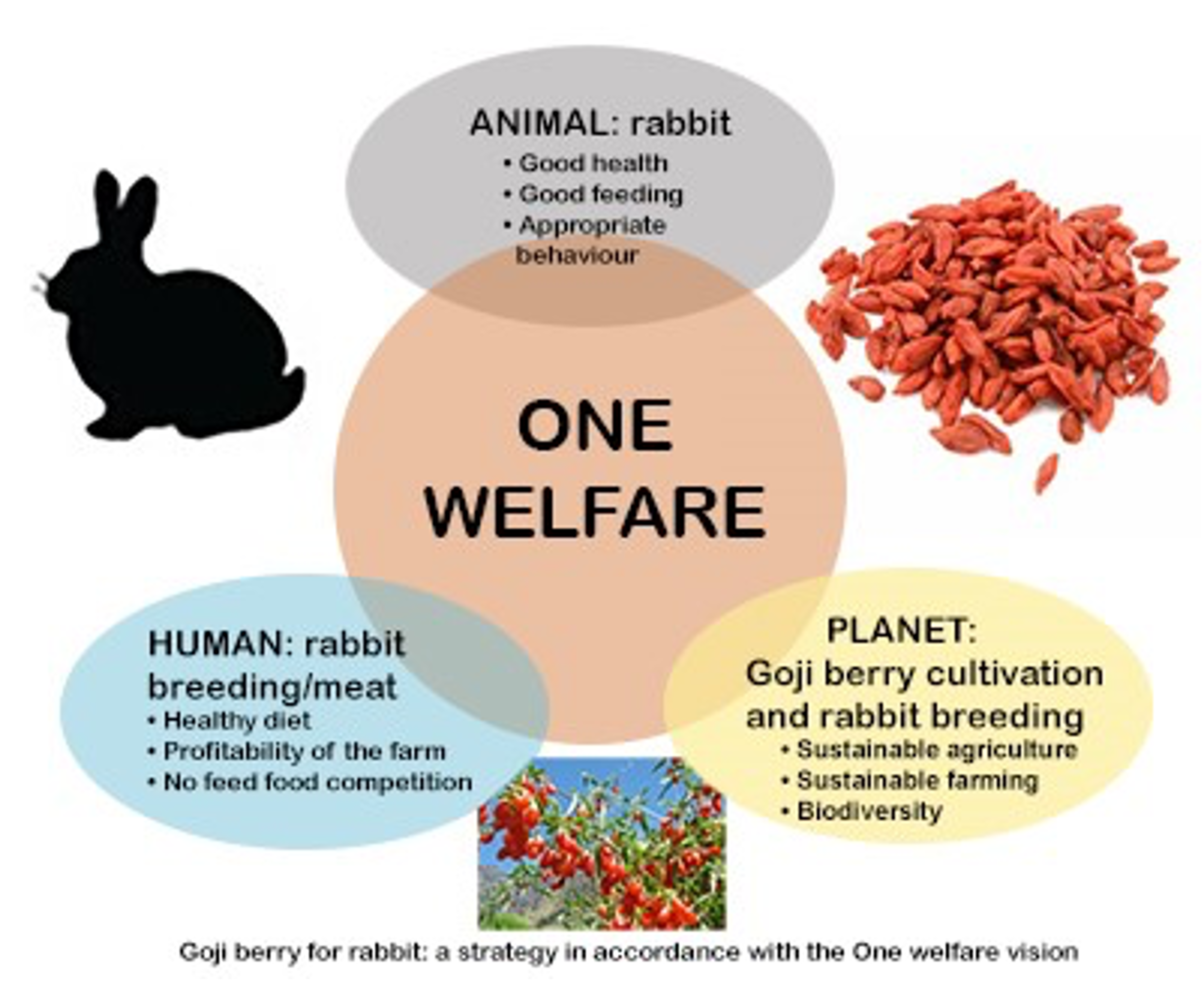 Goji berry (GB), the fruit of Lycium barbarum, is used in traditional Chinese medicine for its nutritional and therapeutic properties and it is also widespread in Western diets. However, only a few studies evaluated its effects on livestock animals, including rabbits. Despite the rabbit meat has high nutritional qualities and rabbit breeding has a role in the sustainability of rural areas, the rabbit industry is going through an economic crisis mainly due to the consumers' negative perceptions. The major concerns are welfare-related issues: use of antibiotics and hormones, feeding management, high exploitation, and scarce health care. In addition, reproductive and digestive infectious diseases cause economic losses for the farmer as they increase mortality, culling rate, and the use of drugs. The project proposes the use of GB in rabbits as a dietary supplement and additive to the final product with the overall aim to improve their immune response, reproductive and productive performance, meat quality, and marketing potential. The validation of new animal-based measures (ABMs) for rabbit welfare assessment completes this One welfare oriented approach. For this purpose, 3 different experimental trials will be conducted. The first will evaluate the preventive effect of dietary GB on the rabbits reproductive and digestive functions using LPS-induced models of local and systemic inflammation. The samples from the gonadal axis, genital, and digestive tract will be analyzed with histological, immunohistochemical and molecular biology analyses to evaluate changes in the tissue organization and expression of orexigenic and anorexigenic peptides, TLR-4, pro and anti-inflammatory cytokines, antioxidant enzymes, and microbiota. Sex hormones and cytokines plasma concentrations will be also determined. The second experiment will evaluate the effects of GB on the digestive functions, immune response, and meat quality. The digestive tract functionality, the microbiota and the metabolic hormonal pattern will be evaluated by molecular biology, immunohistochemical, and radioimmunological techniques. Moreover, the effect of GB as an ingredient into processed meat will be investigated analyzing the meat quality, shelf life, and its potential anti-Listeria effects. Finally, a tool for pain assessment in farmed will be developed, applied, and then validated. This experiment will provide a ready-to-use tool for both veterinarians and breeders to early identify animals suffering from diseases and will define new ABMs for legislation to protect the rabbit's welfare. The project, thanks to a One welfare orientation and a multidisciplinary approach, will bring new knowledge on the relationship between nutrition, inflammation, reproduction, productivity, meat quality, and welfare of the rabbit. Its impact can be extended to scientific, economic, and ethical fields as benefits could concern not only animal welfare but also farmers, consumers, and sustainability.
Goji berry (GB), the fruit of Lycium barbarum, is used in traditional Chinese medicine for its nutritional and therapeutic properties and it is also widespread in Western diets. However, only a few studies evaluated its effects on livestock animals, including rabbits. Despite the rabbit meat has high nutritional qualities and rabbit breeding has a role in the sustainability of rural areas, the rabbit industry is going through an economic crisis mainly due to the consumers' negative perceptions. The major concerns are welfare-related issues: use of antibiotics and hormones, feeding management, high exploitation, and scarce health care. In addition, reproductive and digestive infectious diseases cause economic losses for the farmer as they increase mortality, culling rate, and the use of drugs. The project proposes the use of GB in rabbits as a dietary supplement and additive to the final product with the overall aim to improve their immune response, reproductive and productive performance, meat quality, and marketing potential. The validation of new animal-based measures (ABMs) for rabbit welfare assessment completes this One welfare oriented approach. For this purpose, 3 different experimental trials will be conducted. The first will evaluate the preventive effect of dietary GB on the rabbits reproductive and digestive functions using LPS-induced models of local and systemic inflammation. The samples from the gonadal axis, genital, and digestive tract will be analyzed with histological, immunohistochemical and molecular biology analyses to evaluate changes in the tissue organization and expression of orexigenic and anorexigenic peptides, TLR-4, pro and anti-inflammatory cytokines, antioxidant enzymes, and microbiota. Sex hormones and cytokines plasma concentrations will be also determined. The second experiment will evaluate the effects of GB on the digestive functions, immune response, and meat quality. The digestive tract functionality, the microbiota and the metabolic hormonal pattern will be evaluated by molecular biology, immunohistochemical, and radioimmunological techniques. Moreover, the effect of GB as an ingredient into processed meat will be investigated analyzing the meat quality, shelf life, and its potential anti-Listeria effects. Finally, a tool for pain assessment in farmed will be developed, applied, and then validated. This experiment will provide a ready-to-use tool for both veterinarians and breeders to early identify animals suffering from diseases and will define new ABMs for legislation to protect the rabbit's welfare. The project, thanks to a One welfare orientation and a multidisciplinary approach, will bring new knowledge on the relationship between nutrition, inflammation, reproduction, productivity, meat quality, and welfare of the rabbit. Its impact can be extended to scientific, economic, and ethical fields as benefits could concern not only animal welfare but also farmers, consumers, and sustainability.
Capofila: Università degli Studi di Camerino e CNR_Bari
Partner: Università degli studi di Perugia, Università degli studi di Milano
Settori ERC:LS9_10 Veterinary and applied animal sciences
Web / Social:
PRIN 2022 - Persistence and food safety: an in-vitro study of the persister state in Listeria monocytogens strains to simulate the persistence in the food environment - PERILS
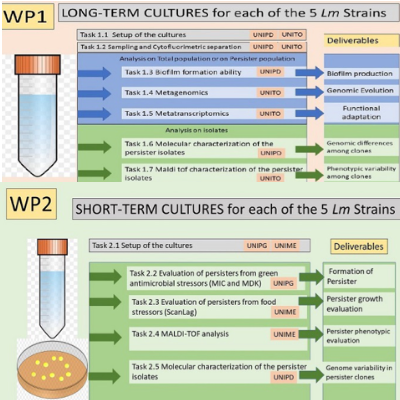 La persistenza nell'ambiente alimentare (strutture e prodotti) di Listeria monocytogenes (Lm) è un problema sfidante nella gestione della sicurezza alimentare. Lm è ancora la prima causa di mortalità nelle infezioni di origine alimentare e la tendenza è sempre in aumento. L'obiettivo del progetto è far progredire le conoscenze sulla persistenza di Lm. La persistenza e la formazione di cellule persister in cinque ceppi di Lm verranno saranno studiate utilizzando un sistema in vitro in presenza di stress subletali (deprivazione di nutrienti, refrigerazione a T°C, basso pH, bassa Aw, stress termico, antimicrobici), utilizzando due approcci diversi. Il primo approccio prevede la creazione di colture a lungo termine in grado di simulare la persistenza in vitro. Un singolo stress (deprivazione di nutrienti) o due tipi di stress (deprivazione e refrigerazione) saranno imposti cronicamente alle colture a lungo termine con l'obiettivo di simulare ciò che potrebbe accadere in un ambiente alimentare reale. Le popolazioni delle colture a lungo termine (cellule persister e non persister) saranno analizzate come popolazione totale o separate mediante citofluorimetro e analizzate separatamente. Inoltre, le colture a lungo termine saranno analizzate per la capacità di formare biofilm, una caratteristica dei batteri spesso associata alla persistenza. Infine, verranno effettuate analisi metagenomiche e metatranscriptomiche sulla popolazione totale e sulle due popolazioni separate e analisi WGS e MALDI-TOF sui ceppi isolati da entrambe le popolazioni. Nel secondo approccio, si valuterà la formazione di cellule persister in seguito a diversi tipi di stress (colture a breve termine), sia quelli classici presenti nell'industria alimentare (temperatura, acidità, detergenti), sia quelli derivanti da antimicrobici naturali. La formazione di cellule persister sarà monitorata con il sistema MIC/MDK o con lo Scan-Lag. Gli isolati persister saranno caratterizzati sia fenotipicamente sia genotipicamente (analisi WGS e MALDI-TOF).
La persistenza nell'ambiente alimentare (strutture e prodotti) di Listeria monocytogenes (Lm) è un problema sfidante nella gestione della sicurezza alimentare. Lm è ancora la prima causa di mortalità nelle infezioni di origine alimentare e la tendenza è sempre in aumento. L'obiettivo del progetto è far progredire le conoscenze sulla persistenza di Lm. La persistenza e la formazione di cellule persister in cinque ceppi di Lm verranno saranno studiate utilizzando un sistema in vitro in presenza di stress subletali (deprivazione di nutrienti, refrigerazione a T°C, basso pH, bassa Aw, stress termico, antimicrobici), utilizzando due approcci diversi. Il primo approccio prevede la creazione di colture a lungo termine in grado di simulare la persistenza in vitro. Un singolo stress (deprivazione di nutrienti) o due tipi di stress (deprivazione e refrigerazione) saranno imposti cronicamente alle colture a lungo termine con l'obiettivo di simulare ciò che potrebbe accadere in un ambiente alimentare reale. Le popolazioni delle colture a lungo termine (cellule persister e non persister) saranno analizzate come popolazione totale o separate mediante citofluorimetro e analizzate separatamente. Inoltre, le colture a lungo termine saranno analizzate per la capacità di formare biofilm, una caratteristica dei batteri spesso associata alla persistenza. Infine, verranno effettuate analisi metagenomiche e metatranscriptomiche sulla popolazione totale e sulle due popolazioni separate e analisi WGS e MALDI-TOF sui ceppi isolati da entrambe le popolazioni. Nel secondo approccio, si valuterà la formazione di cellule persister in seguito a diversi tipi di stress (colture a breve termine), sia quelli classici presenti nell'industria alimentare (temperatura, acidità, detergenti), sia quelli derivanti da antimicrobici naturali. La formazione di cellule persister sarà monitorata con il sistema MIC/MDK o con lo Scan-Lag. Gli isolati persister saranno caratterizzati sia fenotipicamente sia genotipicamente (analisi WGS e MALDI-TOF).
Capofila: Università degli Studi di Padova
Partner: Università degli Studi di Perugia, Università degli Studi di Torino, Università degli Studi di Messina
Settori ERC:LS8_12 Microbial ecology and evolution. 2. LS7_9 Public health and epidemiology
Web / Social:
PRIN 2022 - HACKING EXTRACELLULAR VESICLES (HACK-V): ENGINEERED EXTRACELLULAR VESICLES AS EMPOWERED NANO-SHUTTLES FOR ANGIOGENIC PROTEINS (2023-2025)
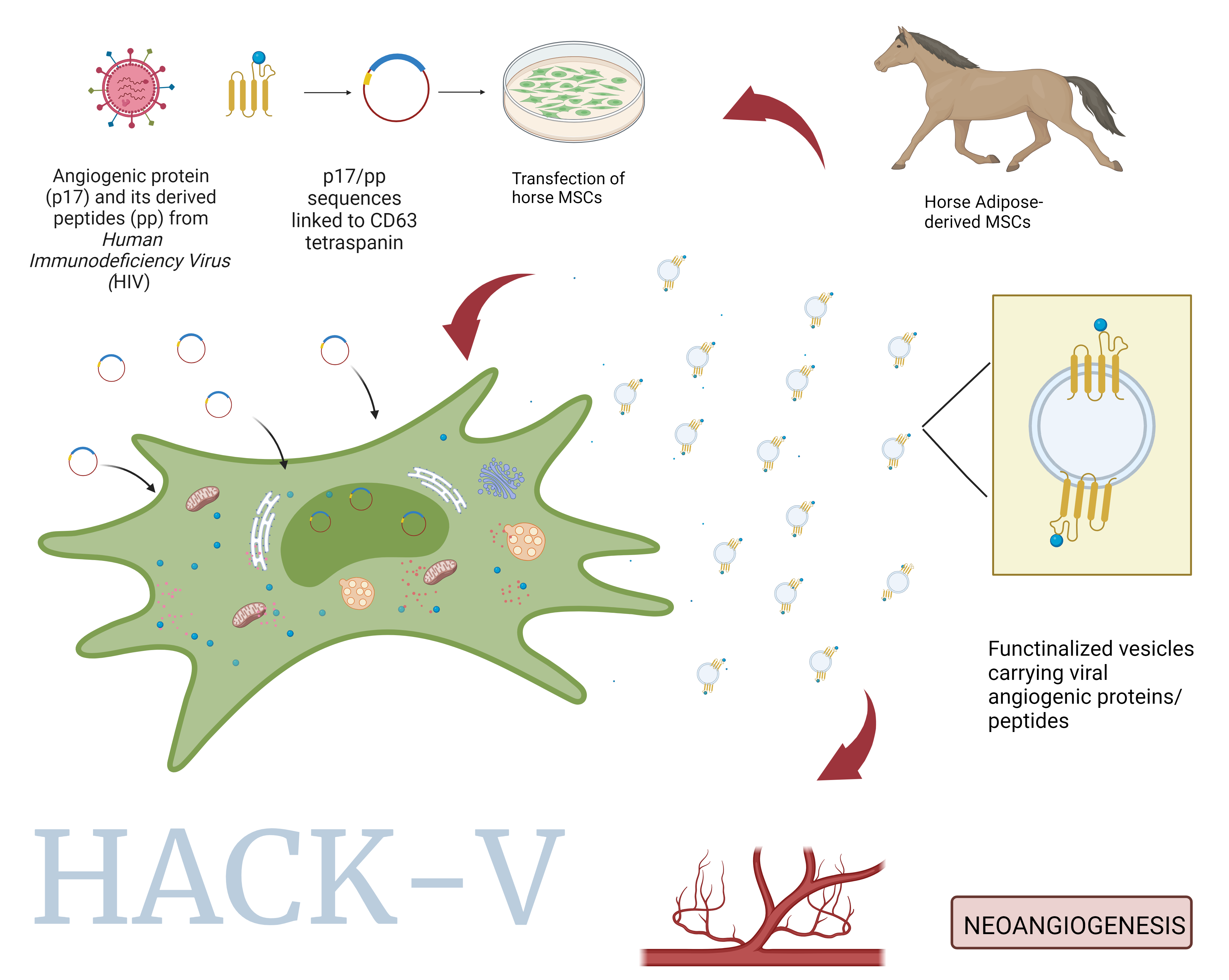 Numerose malattie dell'uomo e degli animali sono caratterizzate da un'angiogenesi insufficiente. La somministrazione di proteine angiogeniche (AP) è considerata una delle strategie più promettenti per supportare la riperfusione dei tessuti lesionati. Tuttavia, molti aspetti critici, come l'inefficienza nel raggiungere selettivamente il sito desiderato, la rapida clearance e la necessità di protezione dalla degradazione, impedisce al momento l'utilizzo delle AP. L'obiettivo principale di HACK-V è quello di sviluppare nano-vettori biologici in grado di veicolare AP nel sito lesionato in modo da preservarne l’attività a lungo termine. Il rilascio controllato di molecole ad azione farmacologica viene solitamente perseguito mediante l’uso di micro e nanoparticelle sintetiche che fungono da vettori. Tuttavia, alcune problematiche quale ad esempio il loro targeting inefficiente, la citotossicità e/o l'immunogenicità ne impediscono l'uso. Le vescicole extracellulari (EVs) sono micro e nanostrutture prodotte dalle cellule coinvolte nella comunicazione intercellulare e caratterizzate da elevata specificità per il bersaglio. Le EVs hanno il potenziale di agire come dei veri e propri sistemi di rilascio naturale (DS) a causa della loro composizione, della bassa immunogenicità, della clearance ridotta, della capacità intrinseca di attraversare le barriere biologiche e della maggiore stabilità nella circolazione sanguigna rispetto ai nano-vettori artificiali. Inoltre, possono essere modificate per esprimere molecole che facilitino il raggiungimento selettivo del bersaglio. EVs derivate da cellule stromali mesenchimali (MSC-EVs) sono state studiate precedentemente dal proponente come trasportatori di farmaci sfruttando la loro capacità di raggiungere il sito danneggiato. Le MSC possono essere ingegnerizzate in modo da “confezionare” EVs che contengano proteine terapeutiche oppure che espongano le proteine desiderate in superficie a livello dei tessuti da rigenerare. L’obiettivo di questo progetto è quello di generare MSC-EVs contenenti p17, una proteina strutturale del virus HIV e alcuni peptidi angiogenici da essa derivati che hanno dimostrato di promuovere la formazione di strutture simili ai capillari a partire da cellule endoteliali (EC) mantenute in coltura. Modelli sperimentali ex vivo ed in vivo hanno ulteriormente confermato l'attività pro-vasculogenica di p17, che sembra addirittura paragonabile a quella esercitata da VEGF-A (Vascular endothelial growth factor-A). A questo scopo, le MSC saranno ingegnerizzate per produrre EVs che trasportino la proteina nativa p17 (EV-p17) e i peptidi derivati da p17 (EV-F2 e EV-F3) così come EVs modificate per esprimere le stesse molecole sulla propria superficie. I costrutti verranno testati per valutare la loro capacità di interagire con cellule endoteliali di cavallo e di influenzare l'angiogenesi in vitro. I risultati attesi forniranno la base per l'uso delle MSC-EV come strumenti di rilascio di proteine e peptidi con potenziali proprietà terapeutiche in malattie dell’uomo e degli animali.
Numerose malattie dell'uomo e degli animali sono caratterizzate da un'angiogenesi insufficiente. La somministrazione di proteine angiogeniche (AP) è considerata una delle strategie più promettenti per supportare la riperfusione dei tessuti lesionati. Tuttavia, molti aspetti critici, come l'inefficienza nel raggiungere selettivamente il sito desiderato, la rapida clearance e la necessità di protezione dalla degradazione, impedisce al momento l'utilizzo delle AP. L'obiettivo principale di HACK-V è quello di sviluppare nano-vettori biologici in grado di veicolare AP nel sito lesionato in modo da preservarne l’attività a lungo termine. Il rilascio controllato di molecole ad azione farmacologica viene solitamente perseguito mediante l’uso di micro e nanoparticelle sintetiche che fungono da vettori. Tuttavia, alcune problematiche quale ad esempio il loro targeting inefficiente, la citotossicità e/o l'immunogenicità ne impediscono l'uso. Le vescicole extracellulari (EVs) sono micro e nanostrutture prodotte dalle cellule coinvolte nella comunicazione intercellulare e caratterizzate da elevata specificità per il bersaglio. Le EVs hanno il potenziale di agire come dei veri e propri sistemi di rilascio naturale (DS) a causa della loro composizione, della bassa immunogenicità, della clearance ridotta, della capacità intrinseca di attraversare le barriere biologiche e della maggiore stabilità nella circolazione sanguigna rispetto ai nano-vettori artificiali. Inoltre, possono essere modificate per esprimere molecole che facilitino il raggiungimento selettivo del bersaglio. EVs derivate da cellule stromali mesenchimali (MSC-EVs) sono state studiate precedentemente dal proponente come trasportatori di farmaci sfruttando la loro capacità di raggiungere il sito danneggiato. Le MSC possono essere ingegnerizzate in modo da “confezionare” EVs che contengano proteine terapeutiche oppure che espongano le proteine desiderate in superficie a livello dei tessuti da rigenerare. L’obiettivo di questo progetto è quello di generare MSC-EVs contenenti p17, una proteina strutturale del virus HIV e alcuni peptidi angiogenici da essa derivati che hanno dimostrato di promuovere la formazione di strutture simili ai capillari a partire da cellule endoteliali (EC) mantenute in coltura. Modelli sperimentali ex vivo ed in vivo hanno ulteriormente confermato l'attività pro-vasculogenica di p17, che sembra addirittura paragonabile a quella esercitata da VEGF-A (Vascular endothelial growth factor-A). A questo scopo, le MSC saranno ingegnerizzate per produrre EVs che trasportino la proteina nativa p17 (EV-p17) e i peptidi derivati da p17 (EV-F2 e EV-F3) così come EVs modificate per esprimere le stesse molecole sulla propria superficie. I costrutti verranno testati per valutare la loro capacità di interagire con cellule endoteliali di cavallo e di influenzare l'angiogenesi in vitro. I risultati attesi forniranno la base per l'uso delle MSC-EV come strumenti di rilascio di proteine e peptidi con potenziali proprietà terapeutiche in malattie dell’uomo e degli animali.
Capofila: Prof.ssa Luisa Pascucci - Università degli Studi di Perugia
Partner: Prof.ssa Cinzia Giagulli - Università degli Studi di Brescia
Settori ERC:LS3_6 Organelle biology and trafficking; LS3_15 Development of cell-based therapeutic approaches for tissue regeneration; LS9_3 Bioengineering of cells, tissues, organs and organismsLS9_10 Veterinary and applied animal sciences, LS6_11 Innovative immunological tools and approaches, including therapies
Web / Social:https://www.instagram.com/prin2022_hackv?igsh=MXc5MjlqNXhvY2Z2bQ%3D%3D https://www.facebook.com/profile.php?id=61562943076458



